36365线路检测中心入口分子酶学工程教育部重点实验室李桂英教授、杨方教授团队在基于介电泳的微流控液体活检以及可控合成功能MOFs材料研究中取得重要进展,相关研究内容已于近日分别在线发表于Biosensors & Bioelectronics、Chemical Engineering Journal杂志。


小细胞外囊泡(small extracellular vesicles,sEV)是一种由大多数细胞分泌的直径小于200 nm的胞外囊泡。它包裹着来源细胞的核酸、脂质、蛋白质等物质,具有脂质双分子层结构,可以反映来源细胞的基因型和表型,是液体活检的理想生物标志物。然而,由于其体积小且密度接近体液,很难在复杂的生物样品中快速分离和检测sEV。因此,迫切需要一种操作简单、快速、集成化的sEV液体活检系统,以克服当前技术所面临的挑战。
鉴于此,团队提出了一种依据交流(alternating current,AC)介电泳(Dielectrophoresis,DEP)技术的sEVs分离和富集检测方法,并设计、制作、验证了相应的微流控芯片(acDEP-Exo)。该方法具有快速、灵敏且可调等特点。通过在芯片反应腔内填充透明玻璃微珠,并在两侧壁上设置电极,构建了非均匀电场,只需通过外加电场产生DEP力就能实现sEVs的富集,而不依赖于抗原抗体结合。此外,透明玻璃微珠的填充不仅有助于扰乱层流,增强sEVs的富集效果,并且还能够将荧光信号聚集,提高sEVs的检测灵敏度。这种基于DEP的微流控液体活检装置仅需要少量的血浆样本(20-50 µL),就可实现低检测限(LOD,161 sEVs/μL)的快速检测(13 min)。该团队同时还利用该芯片对乳腺癌患者和健康志愿者临床血浆样本中sEV的两种标志物EpCAM和MUC1进行分析,发现sEV生物标志物的联合评估具有极高的灵敏度、特异性和准确性。该项研究构建了一种创新的基于微流控介电泳技术的sEV分离和检测方法,为实现基于sEV的癌症和其他疾病快速液体活检提供了一种新方法和新策略,在医学领域的前沿研究和临床实践方面具有重要的科学意义。
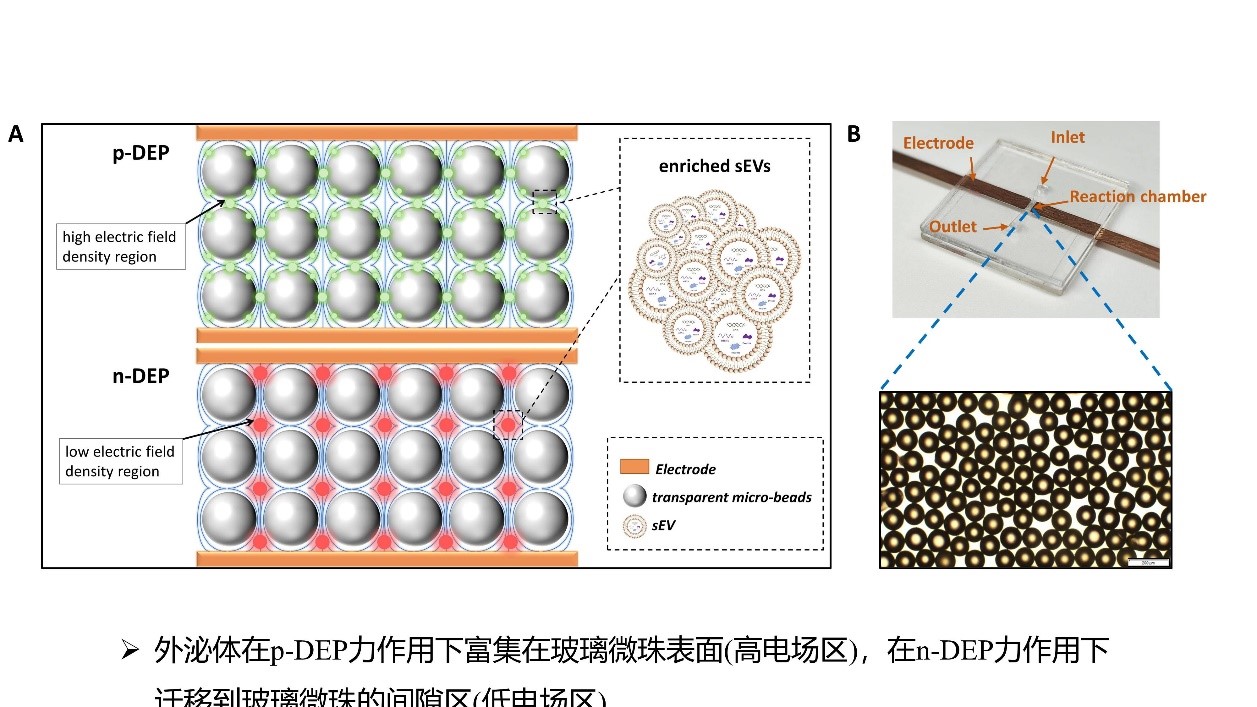
acDEP-Exo芯片的设计和实物图
(A)acDEP-Exo芯片捕获sEV的原理示意图。(B)芯片反应腔中填充透明微珠的实物图。
原文链接:https://doi.org/10.1016/j.bios.2024.116382
另一方面,金属有机框架(MOFs)具有灵活的结构组成和孔隙网络,应用前景广阔。形貌调控技术的发展影响了功能MOFs的实际性能和应用场景。然而,按需生产目标尺寸和形貌的MOFs材料通常受到宏观合成体系的限制,传统合成方案往往需要有机溶剂和添加剂,同时涉及复杂、耗时的样品后处理。团队采用AC-EK技术引导超快速传质过程,从而调节MOFs晶体的成核和生长相。位于流动横向处的AC-EK诱导涡流扰动层流,增加了两液相界面的接触面积,极大地提高了前体合并区内的混合极限。同时,使成核条件达到均匀化并保持不同成核位点间生长速率一致,实现了在室温下对ZIF-8材料进行精准操纵的微流控合成。利用可预测的微体系通过定制晶体自组装过程,改变了ZIF-8的粒径、几何形状、均一性及表面电位,表明了调节流动和混合模式可以控制ZIF-8前体间成核效率,并限制特定晶面的相对生长。此外,发现了不同的ZIF-8结构基于其形貌差异表现出显著不同的固定化性能,在67 V cm-1,100 kHz下合成的ZIF-8具有优越的表面负载大分子能力,对HRP酶负载量达到约16%。结果证明,低场强协同高频信号阻碍了(100)和(110)刻面生长,并促进了具有各向异性表面特征的ZIF-8形成,最终为酶提供了更多开放的固定位点。该研究展示了使用AC-EK混合技术为高附加值晶体材料设计精准合成路线的崭新前景。同时,合成过程不需针对特定分子环境进行定制,这意味着目前的方法可能成为其他MOFs亚家族合成的潜在通用平台。
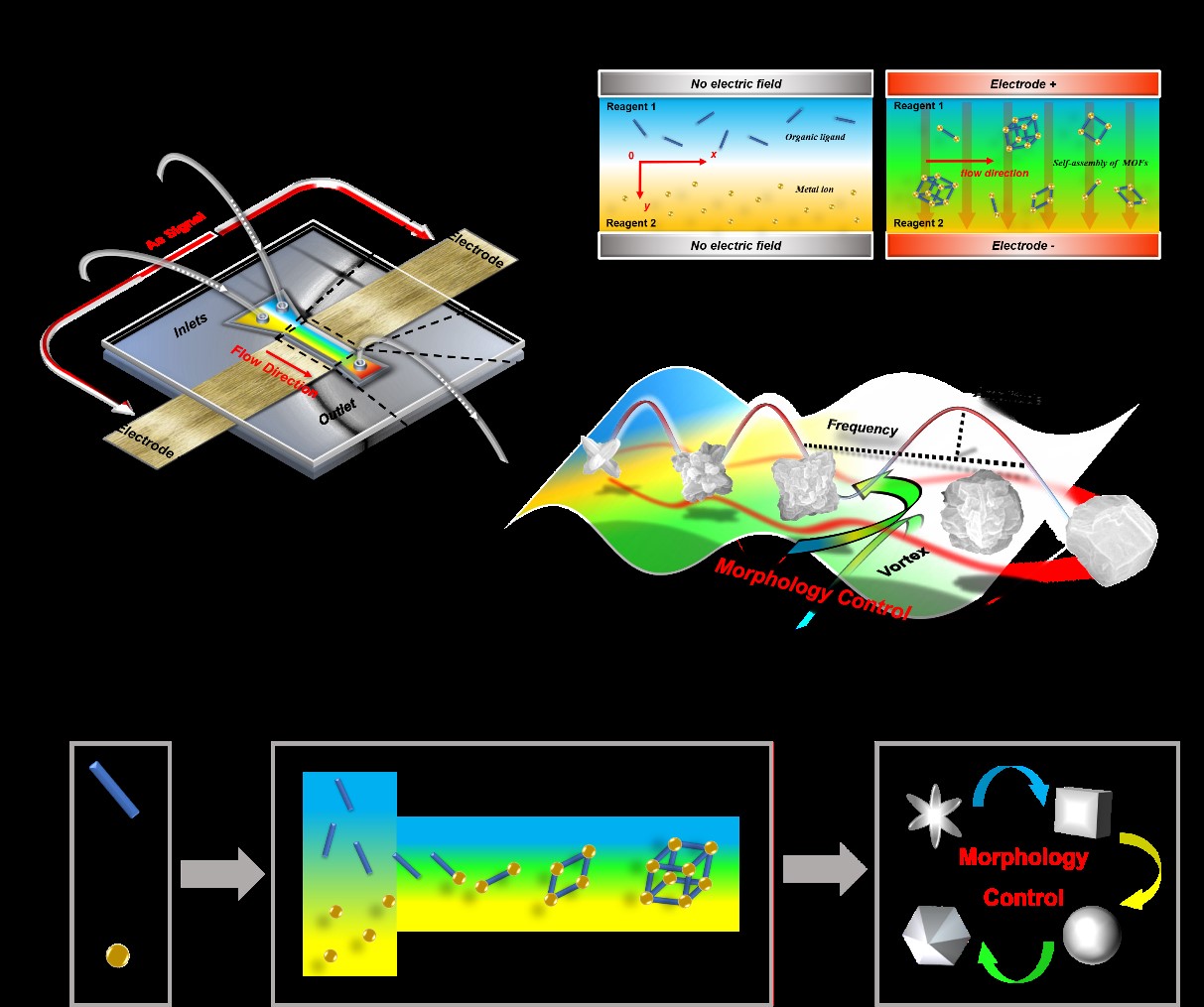
原文链接:https://doi.org/10.1016/j.cej.2023.148208