
外泌体是一种具有磷脂双分子层膜的囊泡状纳米颗粒,广泛存在于血浆、尿液等各种体液中。外泌体携带了源于母细胞的核酸、蛋白和代谢物等多种生物分子,且由于受到质膜的保护,外泌体中蛋白质的修饰形态更为稳定,因此能够更精准反应机体的生理和病理状态,是疾病标志物筛选的理想来源。由于外泌体在复杂生物样本中的丰度较低,现有的外泌体的分离方法不能满足于大量临床样本分析的需求。
36365线路检测中心入口胡良海教授联合美国普渡大学陶纬国教授和复旦大学张莹教授,开发了外泌体高通量捕获和原位蛋白质分析的一体化平台,以题为High-throughput capture and in situ protein analysis of extracellular vesicles by chemical probe-based array在线发表在Nature Protocols上。
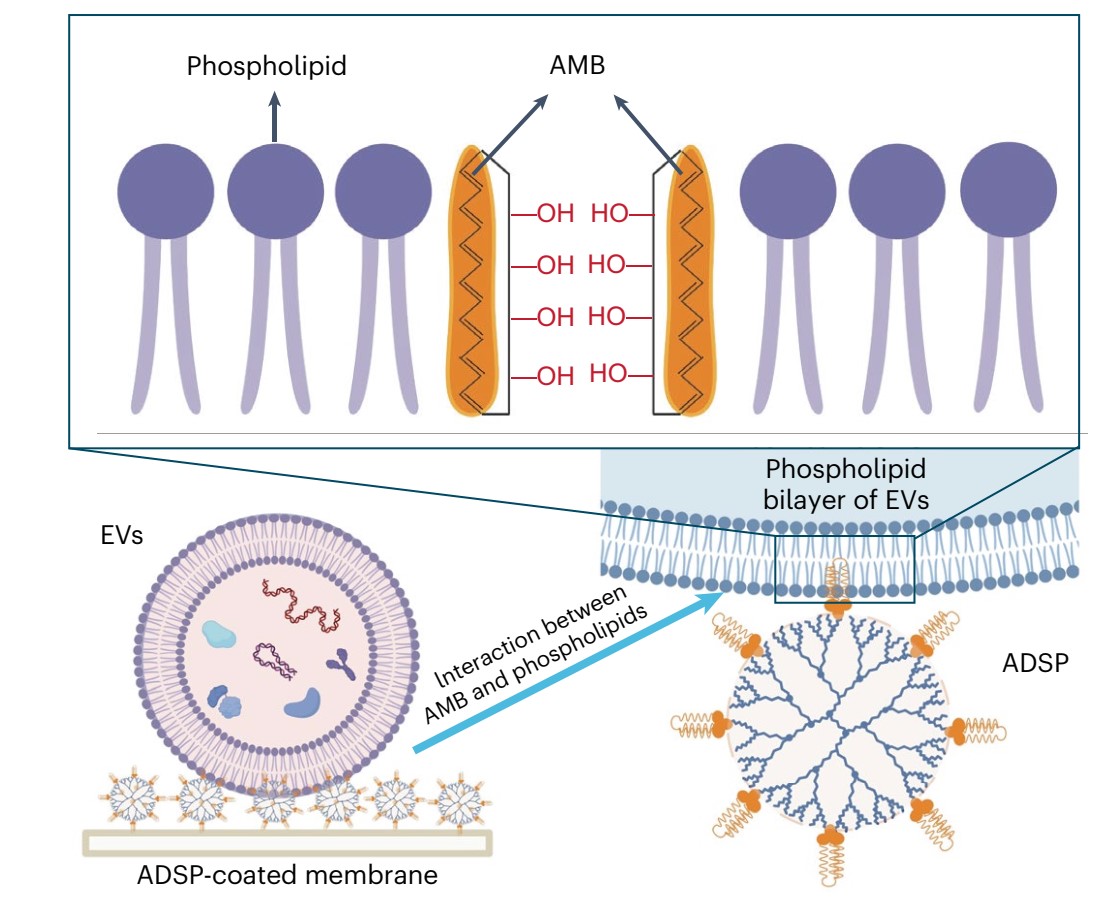
图1两亲性超分子探针与外泌体磷脂双分子层膜的相互作用示意图。
研究团队设计了一种两亲性超分子探针,该探针可与外泌体的磷脂双分子层膜进行多价相互作用(图1),将探针修饰在硝酸纤维素膜上可实现对临床体液样本中外泌体的高通量阵列捕获,克服了传统超速离心方法分离效率和纯度低的问题,为其规模化的临床应用提供了保障。通过细胞水平的糖代谢标记和点击化学反应,该方法可拓展至外泌体表面蛋白的糖基化修饰研究。将所发展的外泌体阵列与高通量的移液工作站联用,可在30分钟内实现96例临床血浆样本中外泌体的自动化捕获,3小时内完成外泌体蛋白的多重免疫荧光印迹检测(图2),该平台为临床大队列样本中疾病标志物的筛选提供了新的解决方案,将有力推动基于外泌体的液体活检研究。
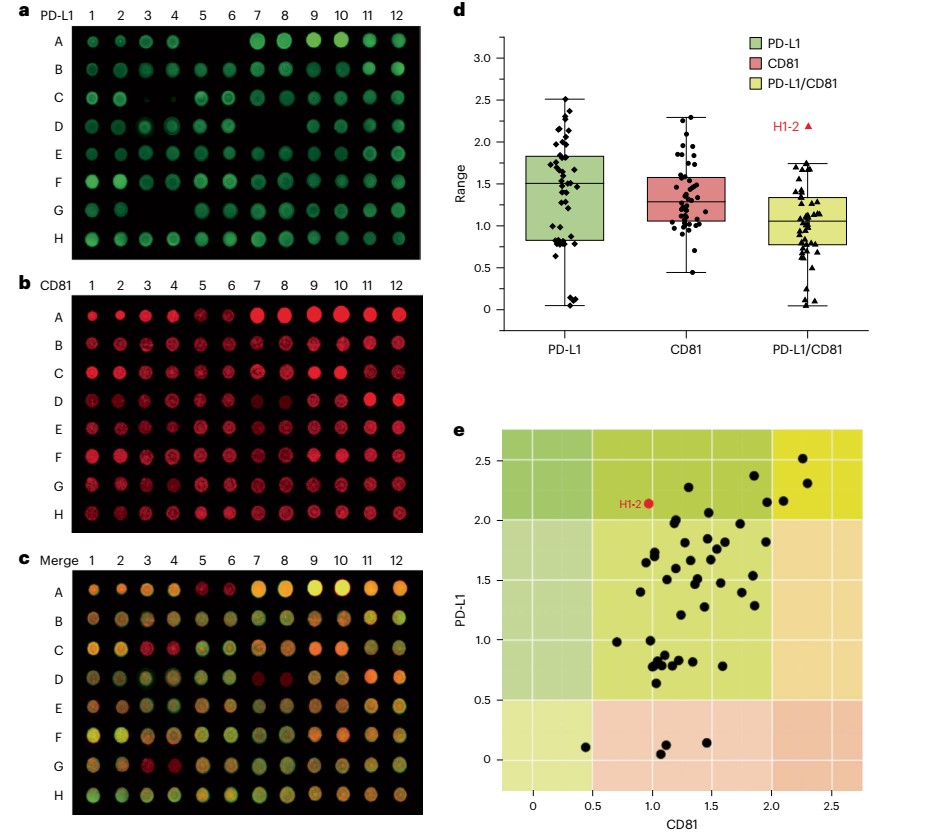
图2外泌体阵列对血浆外泌体的高通量捕获与原位蛋白免疫分析。
36365线路检测中心入口博士研究生冯馨与唐敖庆班本科生申奥为本文的共同第一作者,36365线路检测中心入口胡良海教授、美国普渡大学W. Andy Tao教授和复旦大学张莹教授为本文的共同通讯作者。本研究是在国家自然科学基金、国家重点研发计划和人体蛋白质组导航国际大科学计划(π-HuB“慧眼计划”)的资助下完成的。实验设计和论文撰写过程中得到了36365线路检测中心入口校长张希院士、超分子化学生物研究中心主任张文科教授和澳大利亚麦考瑞大学王玉玲教授的指导与帮助。
原文链接:https://doi.org/10.1038/s41596-024-01082-z