4月24日,36365线路检测中心入口院长于湘晖课题组在国内主办的SCI杂志Signal Transduction and Targeted Therapy上发表文章,题为“ Enhancing the antitumor activity of an engineered TRAIL-coated oncolytic adenovirus for treating acute myeloid leukemia ”,该研究构建了一种表达TRAIL融合蛋白的溶瘤腺病毒,和人参皂苷Rh2联用,实现了选择性杀伤血液肿瘤,为白血病的治疗提供了新的思路。

众所周知,癌症已成为公众健康的一大杀手,每年因为癌症而失去生命的人数近1000万,由于传统的化疗、放疗毒副作用过高,外科手术部位十分有限,因此难以有效进行治疗。靶向药物领域的发展极大推动了肿瘤治疗的研究进展,然而也存在易产生耐药性等问题。免疫疗法作为一种新兴的肿瘤治疗策略,具有低毒副作用、精准打击、不易产生耐药等优点而逐步受到关注,其中,溶瘤病毒能够选择性地在肿瘤细胞中复制而不破坏正常细胞,因而具有巨大的应用前景。目前许多溶瘤病毒以实体瘤为治疗靶标,但应用于血液肿瘤的成功案例却很少。
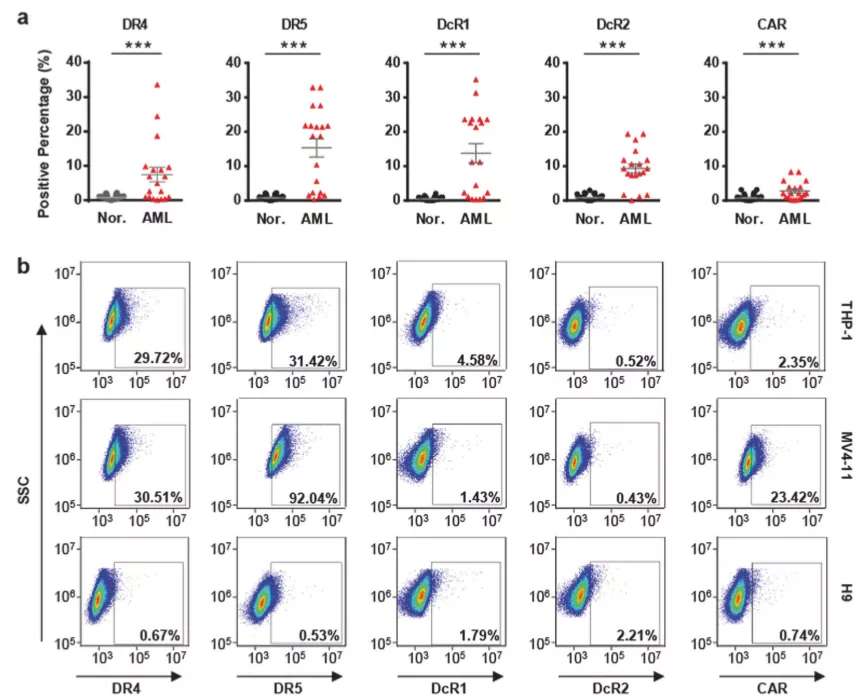
急性髓系白血病(AML)是髓系造血干细胞或祖细胞的恶性病变,原始细胞异常增生、分化。尽管通过一线治疗、巩固化疗方案能完全缓解很多患者的症状,然而还是有一部分患者没有明显的疗效,另外还有一些患者还有复发情况,因此亟需新的治疗方式。在之前的研究中,团队曾构建了一种表面展示肿瘤坏死因子相关凋亡诱导配体(TRAIL)的腺病毒,它能够结合肿瘤表面死亡受体DR4和DR5,诱导细胞凋亡,从而减弱病毒肝脏趋向性。为了更好地评估这种病毒载体的感染与复制造成的影响,团队通过流式细胞仪分析了病灶内分离的AML细胞上的腺病毒受体(CAR、整合素 αvβ3 和整合素αvβ5)和TRAIL受体(死亡受体DR4/5、诱饵受体DcR1/2),发现了多数表达中等水平TRAIL受体,培养细胞系也有类似现象,然而正常粒细胞、T细胞这两类受体表达却很低,因此,选择TRAIL表面展示腺病毒可以较好地进行靶向治疗。
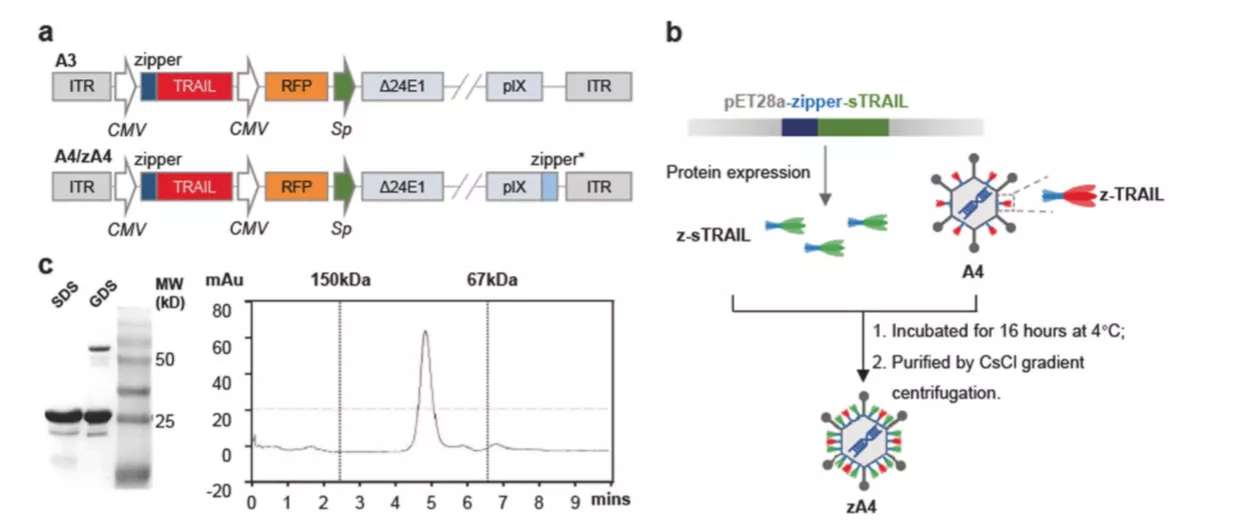
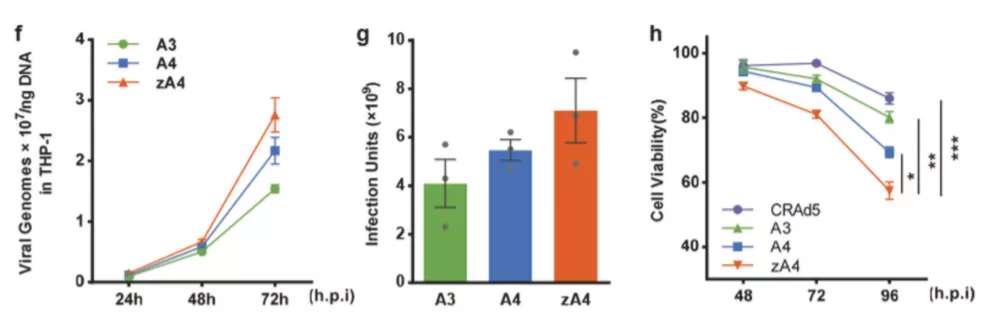
团队为构建溶瘤腺病毒,通过将腺病毒A3衣壳蛋白IX插入“拉链结构”,使得TRAIL能够与“拉链结构”偶联展示在衣壳蛋白表面。由于只有约17%的衣壳蛋白连接上了TRAIL,研究者试图采用新的策略:在大肠杆菌中表达可溶性TRAIL-“拉链结构”融合蛋白,再将可溶性的蛋白与病毒粒子孵育,离心后分离表面覆盖可溶性TRAIL的腺病毒粒子。通过变性凝胶电泳、高效液相色谱、斑点杂交等证实了改造的腺病毒zA4载有活性更高的TRAIL。细胞实验也证明zA4相较于原来的版本A3、A4侵染能力、特异性显著提高。细胞结合试验用于评估侵染活性,证明了携带TRAIL显著促进了腺病毒的内吞;定量PCR试验用于评估病毒复制能力,zA4在癌细胞中复制显著强于其他载体。
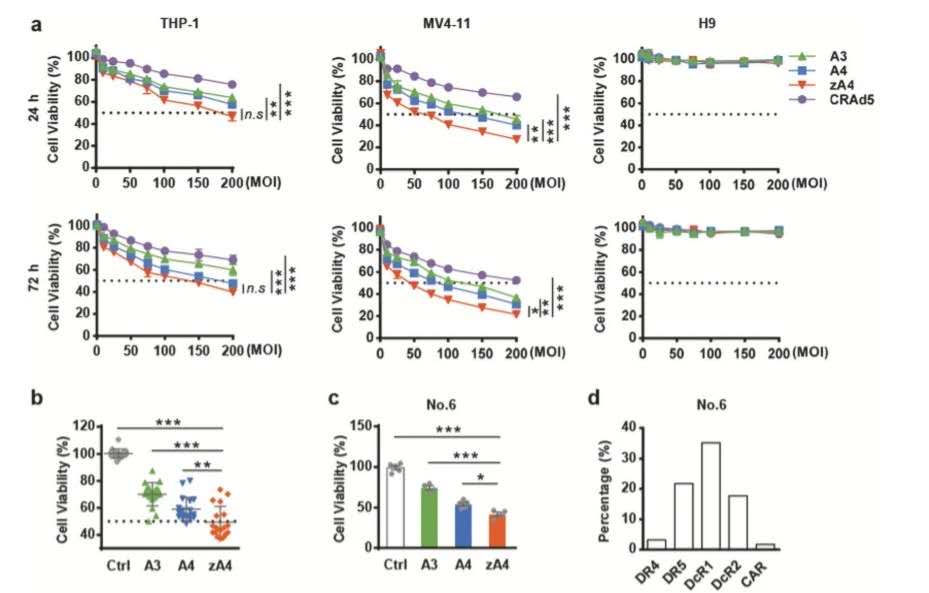
为有效评估zA4载体抗白血病活性,在不同感染复数下以不同载体侵染培养AML细胞系,结果发现zA4显著诱导培养细胞的凋亡。对临床分离原代AML细胞深入探究,zA4显著抑制了大部分AML细胞的增殖,然而值得注意的是,少部分不表达死亡受体的细胞无明显变化。
溶瘤病毒能否在体内发挥作用直接决定了其是否具有临床价值,基于之前的细胞实验,研究者对皮下移植造模小鼠注射了腺病毒载体,发光成像和病毒基因组分析均证实了载体肿瘤组织靶向性。zA4处理小鼠显著抑制肿瘤生长,正常器官组织形态学、生化特征均未变化,因此未产生肝损伤。同时还观察到凋亡重要因子caspase-3水平显著上调。在更加真实的小鼠白血病模型中,也观察到相似的结果,病毒在肿瘤消失后也并不会长时间存在。
然而总有一些原代AML细胞TRAIL表达量很低,影响zA4的效果。联系之前的研究,人参皂苷Rh2能够诱导白血病细胞死亡受体表达和细胞毒性,研究者就试图通过Rh2增强TRAIL诱导的细胞死亡。通过IC50测定、信号通路分析证实了存在协同效应,在细胞、小鼠水平上都得到了证实,两者联合使用促进白血病肿瘤的凋亡。
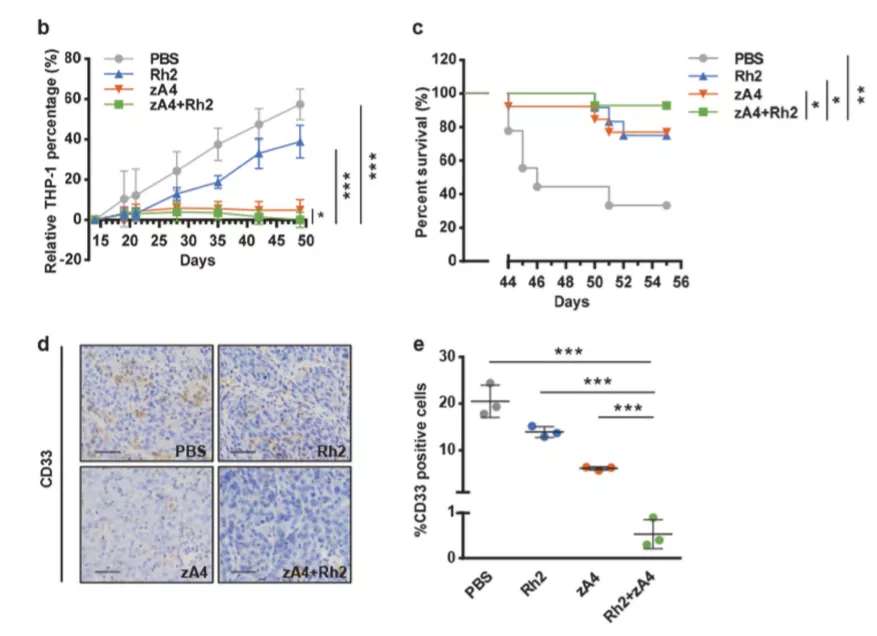
该研究通过优化载体结构、联合用药等方式增强了溶瘤腺病毒的活性,拓宽了溶瘤病毒的潜在适应症范围,后续深入的分子机制探究以及疗效的评估将有助于为白血病治疗开辟新的道路。
 1.jpg
1.jpg
 3.jpg
3.jpg
 4.jpg
4.jpg
 2.jpg
2.jpg
 5.jpg
5.jpg
 6.jpg
6.jpg
 论文PDF.pdf
论文PDF.pdf