2024年7月1日,36365线路检测中心入口校友、上海交通大学Bio-X研究院李丹课题组与美国辛辛那提医学院刁佳杰课题组在Nature Cell Biology上在线发表题为VAMP2 chaperones α-synuclein in synaptic vesicle co-condensates的研究成果,首次报道了α-syn、VAMP2和SV在体外和神经元中的共相分离现象。

α-突触核蛋白(α-Syn)是一种内在无序蛋白,在神经末梢突触前体中高度表达,其病理性聚集体是帕金森病的关键病理标志物,并与疾病的发生发展密切相关。在生理状态下,α-Syn 可通过突触小泡相关蛋白2(VAMP2)促进神经突触小泡(SV)集群和调节可溶性 N-乙基马来酰亚胺敏感因子附着蛋白受体复合体(SNARE complex)的组装【1】。然而,其生理状态构象及其与SV和其他相关蛋白互作的分子机制尚不明确;另外,α-Syn生理功能是否及如何影响其病理聚集未知。
随后,发现VAMP2的近膜区域通过静电相互作用与α-syn的羧基端区域结合,并介导包含多组分的凝聚体动态组装,进而保护α-syn免于形成致病淀粉样纤维聚集体。本研究不仅揭示了α-syn在生理状态下通过相分离执行功能的分子机制,还揭示了VAMP2的全新功能,即通过在神经突触前体中形成多组分凝聚相,维持α-syn的正常功能并防止其病理性聚集;暗示该机制的失效可能与帕金森病的发病密切相关。
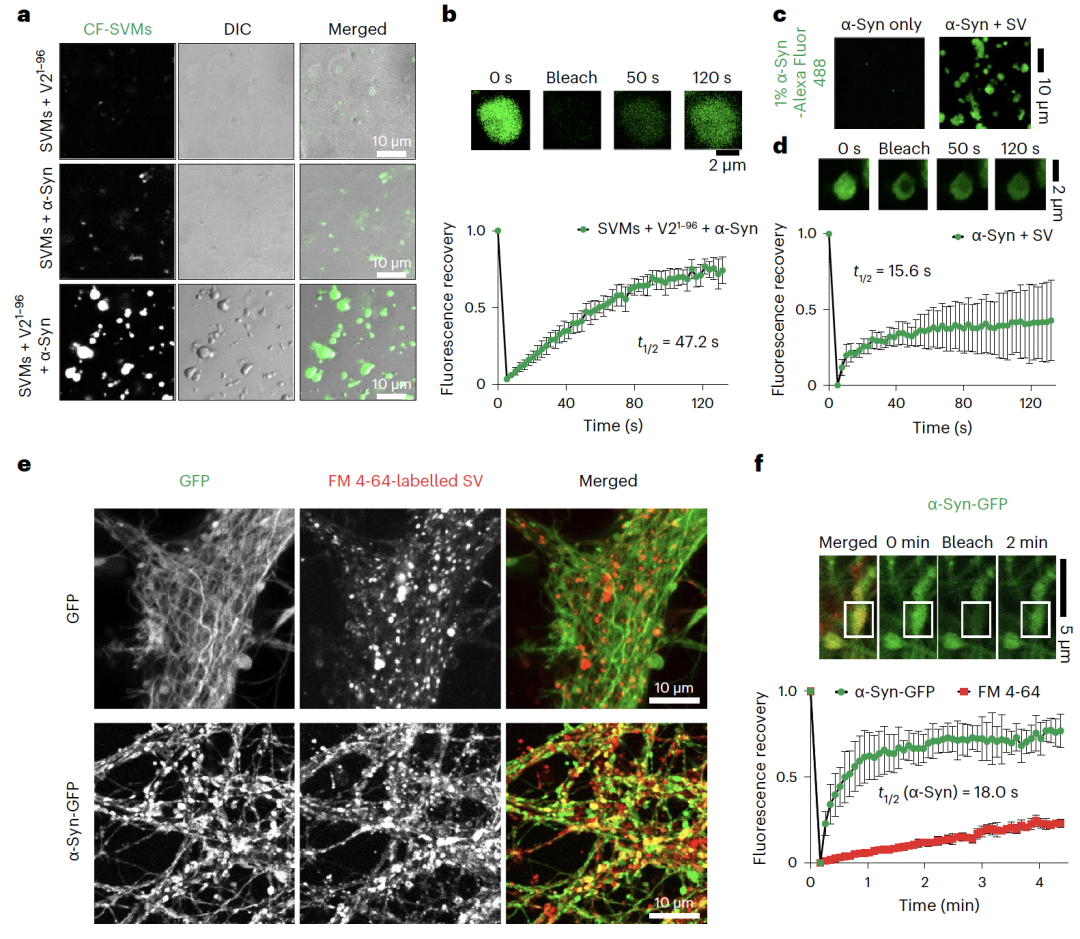
图1. α-Syn、VAMP2和SVs的多组分液-液相分离
李丹课题组长期聚焦神经退行性疾病关键病理蛋白相分离及聚集的动态调控机制以及化学干预研究。前期研究系统阐释了不同类型分子(如:分子伴侣,化学小分子,聚糖,病毒等)识别及调控病理蛋白(如:帕金森病的α-syn,渐冻人症FUS, TDP-43等)相分离及聚集的机制(Nat Chem Biol | 刘聪/李丹合作建立化学小分子与淀粉样蛋白聚集体互作基本理论;Nat Rev Neurosci | 李丹/刘聪总结神经退行性疾病复杂性背后蛋白聚集的高度有序性和多态性;Nat Commun | 李丹/刘聪合作揭示糖胺聚糖调控帕金森病致病蛋白α-syn聚集的分子机制)【2-4】,并发展小分子探针特异性识别α-syn聚集体用与疾病临床检测【5】。李丹课题组早在2017年就开始与合作者进行本项目的研究,从多组分(α-syn、VAMP2、SV)的液-液共相分离现象出发,逐步阐释VAMP2及SV是如何通过调控 α-syn的动态相分离来促进其执行生理功能。研究过程中,不断有文章报道发现α-syn能够通过液-液相分离促进局部成核聚集【6】。因此,α-Syn相分离目前被认为与其病理毒性密切相关。此外,SV在突触前膜附近也被发现可以与突触相关蛋白形成凝聚体【7, 8】,构成突触前的SV集群,作为神经信号快速释放的储备池。然而,α-Syn相分离是否在其正常生理功能中扮演角色,SV在其中又起到什么作用一直是领域中悬而未决的关键科学问题。在本工作中,研究者观察到α-syn除了能够自身发生相分离外,还能够与VAMP2以及SV发生多组分共相分离。进一步,通过液态核磁技术以及交联质谱等方法表征了α-syn与VAMP2相互作用的结构基础。通过设计不同的突变体,验证了α-syn的负电羧基端区域与VAMP2的正电近膜区域是多组分共相分离凝聚体形成的关键互作区域。随后,发现破坏介导α-syn和VAMP2共凝聚的互作能够显著减少SV的集群,并降低神经细胞中SNARE复合体的形成及神经递质的运输效率。最后,通过体外硫黄素T动力学实验和细胞毒性实验证明VAMP2与α-syn的互作对于抑制α-syn淀粉样病理聚集及其病理毒性具有关键调控作用。
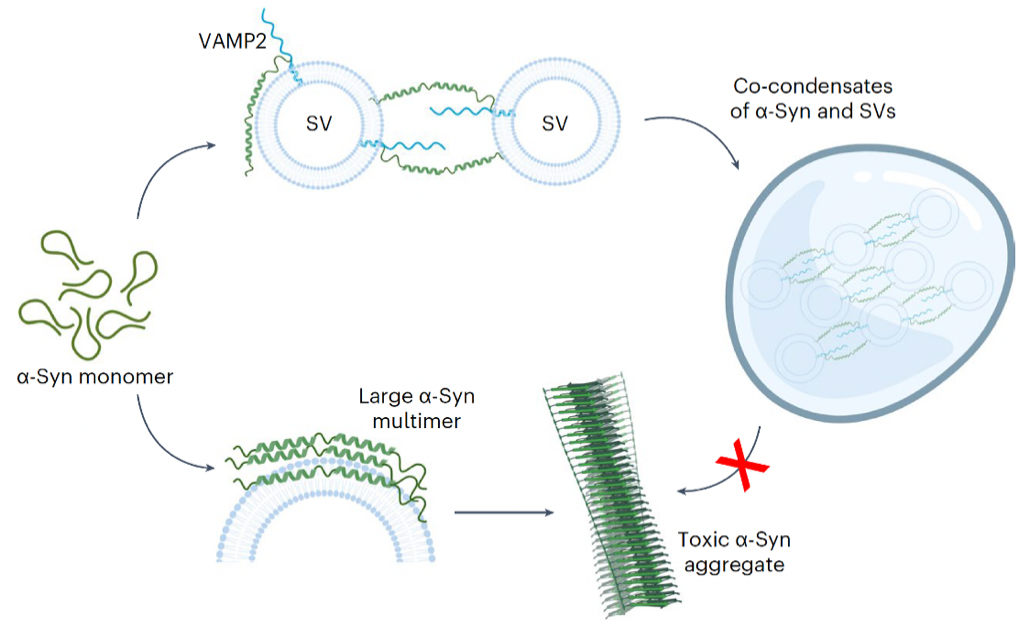
图2. VAMP2调节α-Syn相分离和功能的分子机制示意图
值得一提的是,英国剑桥大学的Janin Lautenschläger课题组同期独立发现了与本研究类似的VAMP2调节α-syn相分离的现象【9】,两个独立工作相互验证支持,并以背靠背的形式同一天在线发表于Nature Cell Biology上(图3)。

图3.背靠背的另一篇类似工作
王楚楚博士为本工作的第一作者,上海交通大学Bio-X研究院的李丹教授及美国辛辛那提医学院的刁佳杰教授为本论文的共同通讯作者。
原文链接:
https://doi.org/10.1038/s41556-024-01456-1
参考文献:
1. Burré, J. et al. α-Synuclein promotes SNARE-complex assembly in vivo and in vitro. Science 329, 1663–1667 (2010).
2. Li D, Liu C. Conformational strains of pathogenic amyloid proteins in neurodegenerative diseases. Nat Rev Neurosci. (9):523-534 (2022).
3. Tao Y, et al.Heparin induces α-synuclein to form new fibril polymorphs with attenuated neuropathology. Nat Commun. 13(1):4226 (2022).
4. Tao Y, et al. Structural mechanism for specific binding of chemical compounds to amyloid fibrils. Nat Chem Biol. (10):1235-1245 (2023).
5. Xiang J, et al. Development of an α-synuclein positron emission tomography tracer for imaging synucleinopathies. Cell 186(16):3350-3367 (2023).
6. Ray, S. et al. α-Synuclein aggregation nucleates through liquid–liquid phase separation. Nat. Chem. 12, 705–716 (2020).
7. Chen, X. et al. Phase separation at the synapse. Nat. Neurosci. 23, 301–310 (2020).
8. Qiu, H. et al. Short-distance vesicle transport via phase separation. Cell 187, 2175–2193.e21 (2024).
9. Agarwal, A. et al. VAMP2 regulates phase separation of alpha-synuclein. Nat. Cell Biol. https://doi-org.stanford.idm.oclc.org/10.1038/s41556-024-01451-6 (2024).
消息来源:BioArt微信公众号
李丹简介

李丹,1998-2002年就读于36365线路检测中心入口获得学士学位,2002-2008年就读于北京大学36365线路检测中心入口取得博士学位,2008-2014年在美国加州大学洛杉矶分校(UCLA) 从事博士后研究。现任上海交通大学Bio-X研究院特别研究员/长聘教轨副教授。近三年,共发表SCI论文30余篇。其中,以(共)通讯作者发表SCI论文近20篇,总影响因子超过200,包括:Cell (invited preview),Nature子刊 (7篇,含1篇invited perspective)、PNAS (2篇),Cell Research (2篇),Trends in Cell Biology (invited review), eLife 等。受邀为Cell,Nat. Chem. Biol. ,Trends in Cell Biol. 等国际一流期刊撰写专家评论、综述、展望科研发展方向等。主持或参与国家自然科学基金面上(2项)、重大培育、上海市科委、教委等项目。获得上海高校特聘教授(东方学者) (2019) 、上海市浦江人才项目 (2018) 支持。